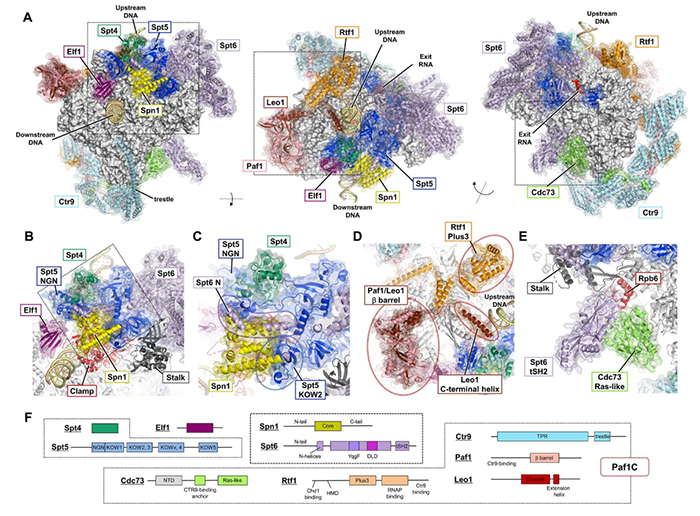
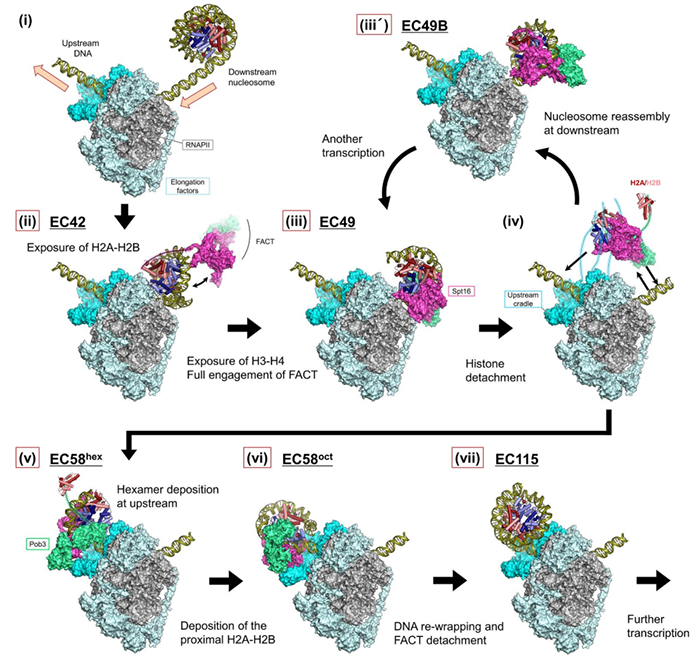
近日,日本RIKEN中心的Hitoshi Kurumizaka和Shun-ichi Sekine研究组利用冷冻电镜解析出RNAPII延伸复合体(EC)通过核小体的多个结构,捕获到EC在DNA上前进的细节,发现EC可介导下游核小体解聚并在上游重新组装,组蛋白伴侣FACT促进该过程。FACT动态地适应持续出现的亚核小体(subnucleosome)中间体,并与EC形成一个互作界面。在EC的DNA出口,延伸因子Spt6、Spt4/5、Paf1C形成一个“摇篮”,支持上游核小体的再组装。上述研究结果以Structural basis of nucleosome disassembly and reassembly by RNAPII elongation complex with FACT为题成文,已在Science杂志发表。在本文中,转录是由毕赤酵母(Komagataella pastoris)RNAPII执行的。作者设计出3种核小体DNA模板以使RNAP停留在第42、49、58、115位,分别对应EC前导边缘靠近核小体的超螺旋位点(SHL)-1、0、+1、+6位。转录机器包含延伸因子Spt6、Spn1、Spt4/5、Elf1、Paf1C、TFIIS,及组蛋白伴侣FACT。作者首先确认EC可停留于上述设计位点,随后使用冷冻电镜收集复合物数据,共解析获得6种EC-核小体结构,分别称为EC42、EC49、EC49B、EC58hex、EC58oct、EC115(图1)。
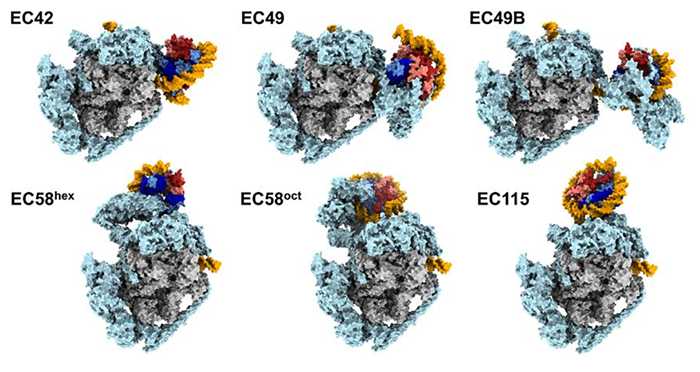
图1 6种EC-核小体整体结构
(其中灰色为PNAP,橙色为DNA、DNA中包裹的是组蛋白)
整体结构中,Spt6、Spn1、Spt4/5、Elf1、Paf1C几乎覆盖RNAPII整个表面,形成一个大型分子工厂(图2A)。Spn1、Elf1及Paf1C的一部分包围下游DNA,形成EC下游边缘;Spt4、Spt5、Spf6及Paf1C另一部分包围上游DNA,形成EC上游边缘;Elf1和Spt5的NGN结构域封住RNAPII的主通道。上述互作形成一个长约40bp的通道,握住转录泡及上下游DNA的一部分。Spt6和Spt5的KOW4、KOW5结构域结合于RNA出口通道,包裹着长约8nt的出口RNA。Paf1C覆盖RNAPII的剩余表面,仅留下次级通道的顶端供TFIIS结合。EC结构包含几个独有特征:Spn1位于RNAPII夹子的顶点,与Spt6的N端螺旋、Spt5的NGN和KOW2结构域互作(图2 B-C);Paf1C的β-桶结构域与TFIIF同源结构域的结合位点有重叠;Leo1亚基的C末端延伸形成一个α螺旋,与上游DNA的大沟互作(图2D);Cdc73亚基的Ras样结构域位于RNAPII茎的根部,与Spt6的tSH2结构域结合(图2E);Rtf1亚基的C端部分形成α螺旋结合于Ctr9亚基。本文获得的前3种EC-核小体结构(EC42、EC49、EC49B)呈现出下游核小体解聚的分子细节。我们一一来看:在EC42中,前导边缘靠近下游核小体的SHL(-1)位,此时核小体中约60bp的DNA已经从组蛋白上剥离开,使得靠近转录起始点的(以下称“近端”)H2A-H2B和H3-H4的DNA结合面暴露。Spn1、Spt6、Elf1及Paf1C与RNAPII一起形成下游边缘,朝向部分打开的核小体。此时的核小体取向类似此前报道的结构【4】,但DNA在SHL(-1)位处解开得略充分些,从而失去与H3 α2螺旋的互作。Spn1和Spt6的N螺旋插入RNAPII与组蛋白之间,Spn1核心结构域与暴露的近端H3-H4直接互作。Spn1和Spt6延伸出的可变尾部密度不可见,但应仍与组蛋白与下游DNA互作。在此状态中,FACT仅通过其Spt16亚基的C端结构域(CTD)结合暴露的H2A-H2B。在EC49中,EC的前导边缘前进至下游核小体的SHL(0)位,即二分位(dyad)。此时,约70bp的DNA已从组蛋白上剥开,致使与近端H3-H4的大部分互作消失。此外,在远端核小体上也有一段约30bp的DNA片段打开,使得远端H2A-H2B的DNA结合面部分暴露。因此,此时组蛋白仅结合约55bp的DNA片段。远端DNA的解聚源于EC结合产生的空间位阻,故近端DNA的打开会减弱远端DNA结合组蛋白的稳定性。在此状态下,FACT主体密度清晰可见,结合于已打开的核小体上。Spt16亚基的中部结构域(MD)与H3-H4四聚体及近端H2A-H2B互作,其中组蛋白部分区段的密度被替换为Spt16 MD的中部区密度。Spt16与H3形成若干疏水相互作用,高度酸化的HA1-螺旋及侧翼loop结合H3-H4暴露的碱性表面。此外,Spt16还重建出一个额外的α螺旋,其顶端的R484残基可与H2A E61、H2B E105互作。Spt16 CTD尾部也与近端H2A-H2B暴露面互作,因此Spt16破坏H2A-H2B与H3-H4间的互作,但稳定了亚核小体结构。通过比较已发表结构,作者认为,只有当EC到达SHL (0) 位并使近一半DNA从组蛋白上解开时,FACT Spt16才完全结合核小体。FACT的另一个亚基Pob3位于核小体背面,其MD与SHL (+1) 位附近的核小体DNA互作。Pob3的二聚化结构域(DD)与Spt16的DD形成一个结构域二聚体(FACT DD),位于SHL(0.5)附近的核小体DNA上。在EC49B中,EC位置不变,但核小体向下游移动约17bp,此时EC与FACT-核小体远远分开。核小体中的组蛋白再次被DNA缠绕,导致Spt16 MD离开组蛋白,但其CTD仍结合于近端H2A-H2B。FACT DD移位至核小体二分位,而Pob3 MD也移位结合于核小体DNA的SHL (0至+0.5) 处。因此,EC49B反映的是FACT-核小体中间体向下游“跳跃”的状态。本文获得的后三个结构(EC58hex、EC58oct、EC115)代表着核小体在上游再组装的细节:在EC58hex中,EC的前导边缘已通过原下游核小体的二分位,此时EC下游已不再有核小体的密度,但在EC上游出现一个亚核小体的密度。FACT结合的组蛋白被置于DNA上,位于EC的DNA出口处,此处位于核小体初始位置的上游约45bp。此时组蛋白仅被约40bp的DNA片段包裹,代表的是上游核小体再组装的早期阶段。Spt4、Spt5 KOW1结构域、Spt6 YqgF和DLD结构域、Leo1 C端螺旋、及Rtf1 Plus3结构域构成DNA出口的边缘,为FACT-组蛋白六聚体提供一个“摇篮”。Spt16 MD与Spt5 KOW1结构域、Spt6 DLD结构域互作,FACT DD与Rtf1 Plus3结构域互作。背面远端的H3与Spt4的酸性表面直接互作。在此FACT-组蛋白六聚体中,组蛋白被Spt16和Pob3 MD包夹着,Spt16 MD结合组蛋白的方式类似EC49。Spt16 MD的HA1螺旋与远端H3-H4的碱性表面互作,因此只有在DNA不结合H3-H4时才可发生。Pob3 MD结合组蛋白的方式不同于EC49,直接与H3-H4四聚体表面互作,这与H2A-H2B的结合位点部分重合,很可能只有近端H2A-H2B缺失时才可发生,因为此时没有空间位阻。此时FACT DD位于一个中间态位置,可能源于前述spt16和Pob3的空间位阻。故,此结构代表的是FACT-组蛋白转移的中间体状态。在EC58oct中,EC位置不变,但组蛋白已变回八聚体。因此EC58oct可能代表的是近端H2A-H2B组装到EC58hex的状态。此时缠绕组蛋白的DNA约75bp,FACT-八聚体结构类似EC49,尽管这里近端H2A-H2B的整个表面已被DNA缠绕。不同于EC58hex,Pob3 MD此时已离开H3-H4四聚体界面,表明H3-H4只能被Pob3 MD或H2A-H2B之一结合。此时,上游DNA稍有弯曲,FACT-亚核小体的取向发生变化,较EC58hex旋转约70°。该变化源于组蛋白由六聚体恢复八聚体,随着DNA结合于近端H2A-H2B,组蛋白八聚体需要改变角度以防与DNA冲突。这时,FACT-亚核小体与EC摇篮的互作方式也发生转变:Spt16 MD通过其HA1螺旋结合Spt6 YqgF结构域、Spt5 KOW1结构域,暴露的远端H3-H4靠近Spt DLD结构域,FACT DD维持与Rtf1 Plus3的互作。在EC115中,核小体已在EC上游接近组装完成。此时,相较EC58,核小体向下游移动约15bp,表明核小体已适应一段更合适的DNA区域。此时,组蛋白上缠绕的DNA约120bp,FACT已从核小体上完全解离,可能因为供FACT亚基结合的组蛋白亚基已被DNA缠绕占据。远端H2A-H2B仅剩的暴露表面被Spt4的酸性界面、Spt5 KOW1结构域结合。此时Leo1的C端螺旋也靠近H2A-H2B,因此,摇篮区可灵活地适应亚核糖体中间体的结构和取向变化,可能为核小体后续在EC上游的再组装过程提供一个支持平台。最后,作者还确认当Spt6、Spn1、Paf1C、FACT缺失时,无论在RNAPII上游还是下游都未观察到明确的核小体结构,说明这些因子对上游核小体再组装至关重要。基于上述结构细节的分析,作者提出EC与FACT协作促进EC通过核小体的机制(图3):当EC靠近下游核小体时,启动DNA从组蛋白上剥离。一旦近端H2A-H2B暴露,Spt16亚基的CTD开始结合组蛋白,但此时FACT大部分仍未结合核小体。直到EC前导边缘靠近核小体二分位,DNA从近端H3-H4上解开,Spt16完全结合组蛋白,Spt16 MD及连接螺旋抓住组蛋白六聚体(H3-H4四聚体及近端H2A-H2B二聚体);远端DNA也同步解缠绕,组蛋白八聚体表面仅1/3覆盖有DNA。随着EC继续前进,组蛋白与DNA解离以便后续转移到上游DNA;此时FACT主体握住组蛋白六聚体,可能还通过其Pob3 CTD栓连着解聚的远端H2A-H2B。随后,位于EC上游侧的摇篮区接手FACT握着的组蛋白六聚体。之前解聚的H2A-H2B再次结合六聚体,组蛋白八聚体再组装。随着EC继续向前,释放出的DNA再次缠绕于远端H3-H4,并促使FACT解聚。在整个过程中,摇篮区不断适应中间体的结构变化,支持核小体的上游再组装。最终,远端H2A-H2B也被DNA再次缠绕,EC上游形成完整的核小体结构。总结全文,作者使用冷冻电镜解析出一系列包含转录延伸因子Spt6、Spn1、Elf1、Spt4/5、Paf1C及组蛋白伴侣FACT的RNAP-核小体结构,通过对结构细节的分析归纳出核小体在EC下游解聚并在上游再组装的分子机制。本研究获得的结构为EC穿过核小体的同时保持染色质结构和表观信息提供机制解释。http://science.org/doi/10.1126/science.abp9466